2020年4月10日海关总署2020年第53号文:自4月10日起,对“6307900010”等海关商品编号项下的医疗物资实施出口商品检验。详见《医疗防疫物资法检官宣刚刚落定,两个重点,看过来!》
继该公告之后,口罩出口出现短暂“熔断”,随即大反转,在4月11日海关总署印发《海关实施出口医疗物资法定检验工作方案》的通知(署监发「2020」72号),对于第53号公告的具体操作做出了权威解释!
公告明确:对53号公告所列11类出口法检医疗物资企业通过单一窗口申报报关,不同于其他出口法检商品的是,此次新增法检出口医疗物资采取验证管理方式,无需实施产地检验,报关时无需出口电子底账。
具体内容摘要及解读如下:
按照72号文件要求,对于53号公告规定的11类(19个商品编码)出口法检医疗物资,采取的是验证管理方式,就是不需要做商品品质检验,无需出口电子底账,企业正常申报报关单。
单证提交要求:在三部委发布的“5号公告”里的5类医疗物资,提交医疗器械产品注册证和企业承诺声明;在三部委发布的“5号公告”外的医用物资,企业提交注册证和质量安全承诺书,非医用物资不要求提交注册证和质量安全承诺书。
海关审核要求:三部委5号公告涉及5类医疗物资,而海关53号公告涉及11类医疗物资。其中,4类相同,7类不相同。但都是对于医疗物资的新措施,不是对于非医疗物资的新措施。所以,海关申报系统中并没有对53号公告中的19个HS设置出口商检监管条件。海关采取电子审核加人工审单的方法,处理53号文件涉及的申报单证,涉及53号公告的出口防疫物资申报时,不需要电子底账,数据不走ECIQ系统。三部委5号公告的4类商品按5号公告要求办理,需提供中国医疗器械产品注册证和企业承诺说明书,不需要做产品法定检验。对53号公告新增的7类商品,综合业务岗位几乎100%人工审单,发现未放行的可以联系海关审单部门。对非医用的,若没被布控,直接放行;对医用的,需企业提供注册证书(可以是电子扫描件)及出口企业的质量承诺书,有上传的,原则上(被风险布控或者综合业务岗人工审单有疑问的、决定布控除外)予以放行,没有上述注册证书或者出口企业质量保证承诺书的,将可能被布控。
查验资料要求:如果产品涉及医疗物资,企业需提供注册/备案证明和质量安全承诺书。对于现场无法判定或企业提出异议的送实验室检测。72号文中明确了“在确定是否为医疗物资时,应根据商品本身特征而非申报用途”。

小贴士:
也许是考虑到多数企业没有缓冲期过渡,从应对时间和成本上,最终法检的实锤还是没有落定。但是,汉连小编认为:53号公告的产生并非完全鸡肋,而是一个明确的信号灯,维护国誉商誉形象,全面提高出口质量,国家出手了。正面去理解这个公告,其实是倒逼国内产业质量安全提升,只有通过不断提升产品质量安全水平才能从根本上跨越国外技术性贸易壁垒。
此次公告反转事件之后,医用与非医用口罩,在查验时如何认定,外包装的CE与FDA又是否影响通关,成为大家最为关心的也是近期咨询量最大的话题,一起来研究下:
首先,医用与非医用的认定标准并不是通过用途来判断,而是通过产品的技术标准参数来认定。正规途径生产的口罩产品的最小单元包装上应该要有商品名称、执行标准及防护等级等信息。因此,外包装上如何标识,直接影响判定结果。
※ 商品名称中带有“医用”或者英文 “surgical””Medical”等字样,一般可判定为医用口罩。
※ 外包装有 “FDA”标识
医用口罩在美国属于医疗器械,适用《医用口罩材料性能标准规范》(ASTM F2100),由美国食品药品监督管理局(FDA)管理,须通过501K注册或近期FDA公布的其它途径,获得工厂注册和医疗器械列名后方可在美国上市。因此,输往美国的口罩外包装或检测报告或证书上有“FDA”或ASTM F2100标准,可被判定为医用口罩。

※ 外包装有 “CE”标识
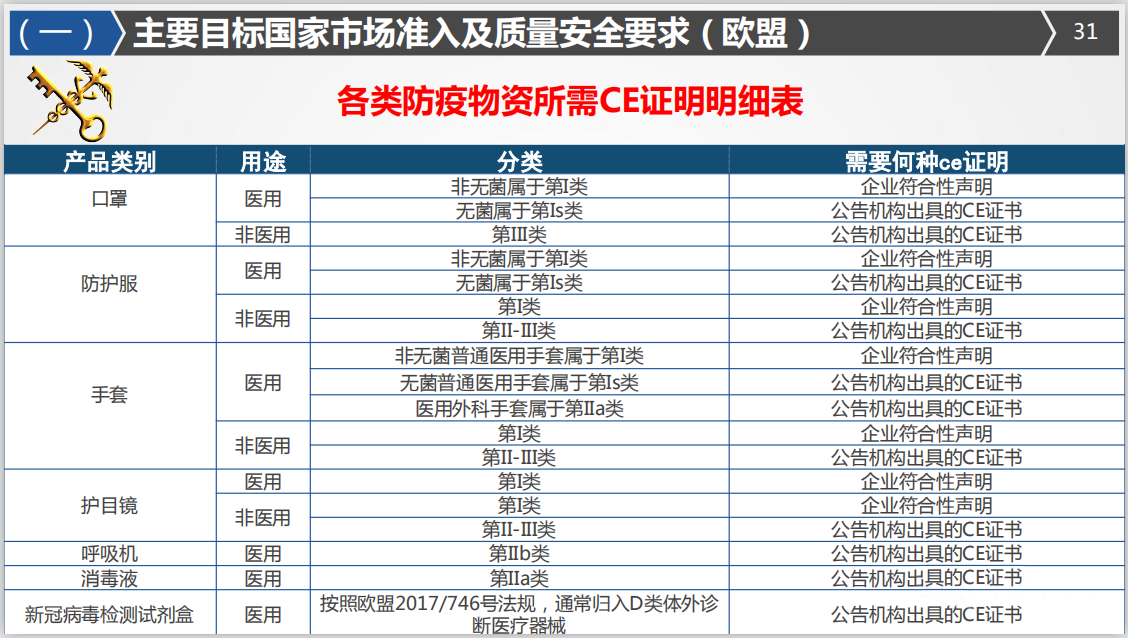
欧盟医用/非医用口罩均需加贴CE标志,但适用标准不同。
医用口罩在欧盟属于I类器械,分为I类非无菌和无菌两种,需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683,输往欧盟的口罩外包装或检测报告、证书上有上述内容的,可被判定为医用口罩。
需要注意的是,根据口罩无菌/非无菌状态,欧盟采取不同的合格评定办法,非无菌医用口罩企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。无菌医用口罩还必须由授权公告机构进行CE认证。
出口欧盟非医用口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
所以说,有CE标识的话,要根据CE后面的具体执行标准来判定是否医用,如CE 标识,执行标准为EN149,则可判定为非医用口罩,如执行标准为EN14683,则可判定为医用口罩。
※中国医用标准:
输往其它国家和地区口罩产品,可参考其提供的中国标准检测证书与注册备案信息进行判断,中国医用口罩标准有三个,GB 19083-2010、YY 0469-2011、YY/T 0969-2013,使用这三个标准生产的口罩可被判定为医用口罩。
希望各工厂生产包装盒子的时候严格按照产品类型及符合标准进行包装。

此外,外包装除了体现以上执行标准外,还必须要有“合格证”,合格证上必须要有:厂商、生产日期、保质期等要素,否则也不算规范包装,视为三无产品,将面临严重处罚。
关于合格证的合规体现详见《4月起,口罩出口新攻略,资质不全,随时扣关!》
厦门汉连供应链有限公司现已申请到第二类医疗器械经营备案,并为希腊、马来西亚、罗马尼亚、新加坡、欧美等海外客户顺利报关出口各类口罩及防疫物资,对于海关新规、口罩类型及不同国家标准资质都有专业探索。
防疫物资咨询热线TEL:15980838018(微信同号)备注企业名称,可获得免费咨询。
汉连防疫物资出口官方客服微信号:





