12号公告发布以来,五类重点医用防疫物资及非医用口罩产品的出口、质量监管、海外注册资质认证等问题引发了各界的广泛关注。我会受商务部委托,对取得国外标准认证或注册的生产企业资质进行核实确认,并受权在商会网站公布名单。近期,我会就大家比较关注的问题进行了梳理总结,现答复如下:
商务部关于12号公告回应的热点问题
1、出口的非医用口罩是否应在包装上标明生产日期、品牌以及产品执行的质量标准?包装内是否应提供质量检验合格证?
答:按照有关法律法规及《关于进一步加强防疫物资出口质量监管的公告》(商务部 海关总署 国家市场监督管理总局2020年第12号公告),出口的非医用口罩外包装应如实标明生产日期、保质日期及执行的技术标准等信息,不得印制医用标志。对包装内是否提供质量检验合格证、包装上是否标识品牌不做强制要求。
2、执行企业标准或团体标准的非医用口罩能否正常出口?
答:按照12号公告规定,如所执行企业标准或团体标准在出口方和进口方共同声明中得到双方确认,企业可以按照中国质量标准申报,且生产企业不在市场监管总局提供的国内市场查处的非医用口罩质量不合格产品和企业清单内,出口企业报关时提交出口方和进口方电子或书面的共同声明的,相关产品可正常出口。
关注问题的回应
1、12号公告涉及的产品范围有哪些?
答:12号公告加强了非医用口罩出口质量监管,进一步规范医疗物资出口秩序。根据12号公告精神,在我会网站公布的生产企业清单均为由商务部确认的,已取得国外标准认证或注册的生产企业,产品涉及非医用口罩、新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机和红外体温计。
据海关总署数据显示,3月1日至5月16日,全国共验放出口防疫物资价值1344亿元。其中,口罩509亿只;防护服2.16亿件;新型冠状病毒检测试剂盒1.62亿人份;呼吸机7.27万台;红外测温仪2643万件。
2、近日,美国FDA对已获得EUA授权的中国口罩生产企业数量进行了核减,商会对此有何评论?
答:我会注意到,近日美国FDA将获得EUA紧急授权的中国口罩生产企业数量进行了核减。在确认相关消息的真实性后,我们随即对已在我会网站公布的取得美国FDA的EUA紧急授权的生产企业清单进行了调整。
防疫物资质量直接关乎各国人民的生命健康。各国都有自己严格而独立的质量监管体系和质量标准规范。疫情爆发后,包括美国在内的各国纷纷向中国提出医疗物资采购需求。在有序组织出口、驰援各国抗击疫情的同时,中国政府有关主管部门连续发布加强防疫物资出口质量监管的5号公告和12号公告,采取有力举措严把市场和出口质量关,确保出口的产品质量合格、安全可靠,符合进口国(地区)的质量标准要求,保质保量向国际社会提供急需的防疫物资。中国广大生产企业加班加点,尽可能多地向全球提供质量合格的防疫物资,让各国最终用户放心。这一系列举措,是尊重生命、尊重市场法则的务实体现。
针对中国企业因“产品质量检测不合格”被FDA核减移出名单的情况,部分相关企业反映,其产品并未出口美国,对美方有关检测不合格的说法提出质疑;还有的企业反映,美方CDC检测报告中所附的检测样品并非该公司产品,已要求美CDC做出澄清。此外,美方突然核减中国出口企业,令相关企业普遍面临在谈合同签订和已签订合同的履约问题。我会提醒广大中国出口企业,严格遵守进口国(地区)的法律法规,依法合规经营。在实现出口前,一定要跟踪了解进口国家(地区)对防疫物资的监管要求,密切关注其法律法规和政策变化,及时调整出口策略,充分运用市场规则保护自己的利益,防范合同履约风险,减少不必要的损失。
3、哪些产品需要递交申报材料并进行资质确认?
答:按照12号公告要求,企业递交申报材料的产品范围为取得国外标准认证或注册的新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计、检测试剂盒等五大类医用防疫物资以及非医用口罩。
手套、鞋套、监护仪、手术衣、隔离衣、呼吸器、复苏器、呼吸面罩、制氧机、呼吸机配件等非12号公告范围内的产品无需申报。
4、企业需要报送的材料有哪些?医保商会是否接受企业的直接申报?
答:企业需要报送取得国外标准认证或注册的资质文件。合同、承诺书、买卖双方说明、声明等文件不必上报。
请企业与地方商务主管部门沟通申报事宜,了解申报所需要的材料和要求,并索取相关申报表格。各地方商务主管部门组织本地防疫物资生产企业填报有关表格并提交相关证明材料,在初步审核后统一报送至商务部外贸司,同时抄送我会。我会不接受企业直报(包括新报和补报)。
5、企业提交材料中的常见问题有哪些?
(1)5类医用防疫物资常见问题
关于欧盟认证:
a.未提供符合性声明文件(DoC)(或声明上无签章)
b.未提供在欧盟当局登记注册的凭证(或凭证上无注册号或监管当局签章)
c.符合性声明文件(DoC)和在欧盟当局登记注册的凭证不匹配
关于美国FDA认证:
a.企业只进行了工厂注册和产品列名,并未获得美国FDA 510k批准。
b.企业申报的类别有误,如申报的医用口罩,但产品代码为LYU、KHA、BSJ、BYG、KGB、MSH、OKR等,这些都不是医用口罩代码。
(2)关于非医用口罩认证:
a.企业提交了无效证明文件,以下机构证书文件无效:ECM、ICR、CELA、ISET、NPS、STS、VIC、NTC等。
b.有国内机构出具的测试报告,按照GB2626国内标准进行的,无境外机构出具的PPE证书。
(3)其他问题:
a.证件持有人与申报公司名称不符,需要企业提供说明函证明二者关系。
b.企业信用代码或英文名错误
6、欧盟对于防护类口罩是如何进行分类的?
答:防护类口罩在欧盟属于个人防护用品,就是我们常说的PPE(Personal Protective Equipment),按等级分为FFP1、FFP2和FFP3。防护类口罩适用的法规是 (EU) 2016/425个人防护装备法规,属于该法规规定的III类产品。测试标准为EN149:2001+A1:2009。
7、防护类口罩如何进行CE认证?
答:根据 (EU) 2016/425 PPE法规的规定,防护类口罩必须获得Module B(型式检验认证)+ Module C2(内部质量控制+产品随机性监督抽查)或 Module D(生产过程质量控制)证书后,方可在欧盟合法销售。简单来说,就是必须Module B + Module C2 或 Module B + Module D二选一。
8、什么样的认证机构可以从事防护口罩的CE认证?
答:只有获得欧盟委员会 (EU) 2016/425 PPE法规口罩产品Module B、Module C2和/或Module D授权的认证公告机构才有权从事防护口罩的CE认证活动。
欧盟认可的个人防护用品公告机构名单如下:
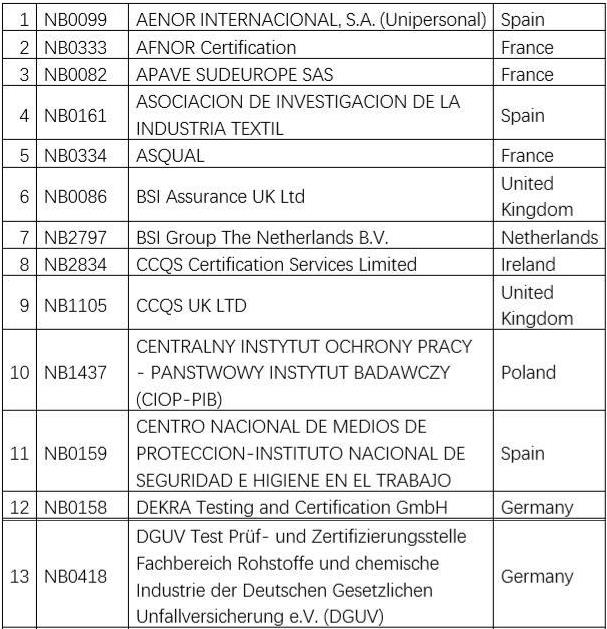
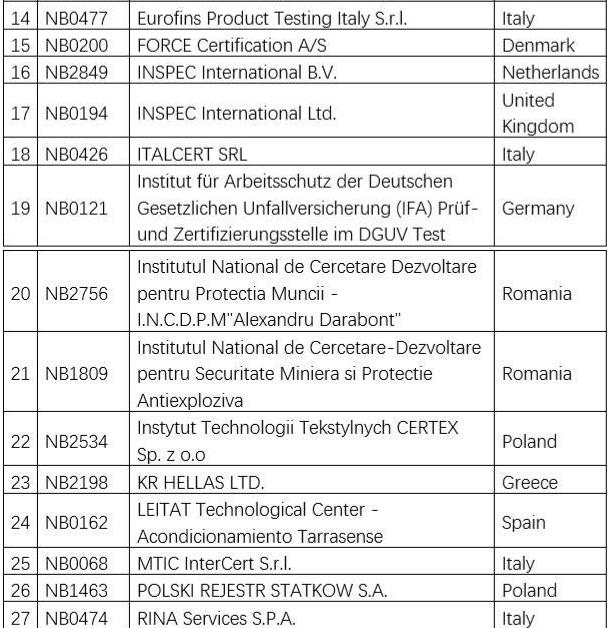
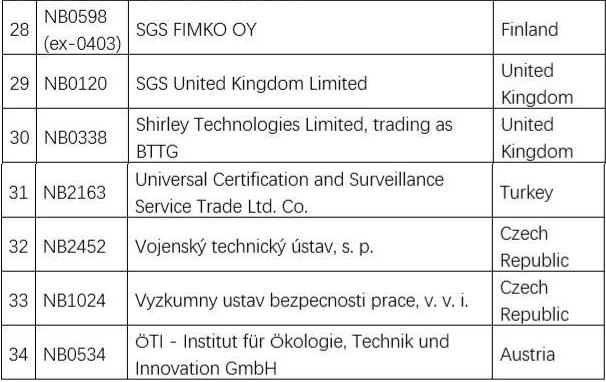
也可通过以下网站查询:https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
有效认证机构的证书图例:


任何无个人防护用品(PPE)法规授权的认证公告机构、不具备Module B、C2和/或D资质的认证公告机构、不是认证公告机构的中介机构,都没有权力进行防护口罩的CE认证活动。
无效防护口罩认证机构证书图例:

中国境内合法的中介认证机构有哪些?
中国境内具有口罩等防疫用品CE认证能力的认证机构名录

厦门汉连供应链有限公司现已申请到第二类医疗器械经营备案,并为希腊、马来西亚、罗马尼亚、新加坡、欧美等海外客户顺利报关出口各类口罩及防疫物资,对于海关新规、口罩类型及不同国家标准资质都有专业探索。
防疫物资咨询热线TEL:15980838018(微信同号)备注企业名称,可获得免费咨询。
汉连防疫物资出口官方客服微信号:





