继国家三部委公告连连出击之后,5月,进入口罩的缓冲期。我们连线了汉连报关行的报关现场,实时了解防疫物资出口的报关动态、验放要求。
连线-报关行:从近期的口罩申报数量来看,虽然五月还未结束,但相较于4月份同期,有较为明显的下降,而其他防疫物资,例如手套、新冠检测试剂有所上升。报关的宗旨和准则依然是5号公告+12号公告,外加现场验放的一些经验及小变动,例如口罩执行标准的认定。
同时,通过4月份的一场关务咨询直播,收到了许多工厂、贸易商的咨询,从客户的提问过程中,就已经存在了一些比较常见的误区,我们将这些共性问题的误区整理并汇总行业经验,供大家参考学习:
来自小伙伴的各种误区:
误区一:所有进入欧盟市场的一次性口罩,都要获得CE认证证书?
A: CE认证是产品进入欧盟市场的一种合格评定方式,它一般有自我申明和认证机构认证证明的两种形式。
在欧盟一次性口罩分为医用和个人防护(PPE)两大类。
医用又分为无菌和非无菌两种,检测标准为EN 14683:2019。个人防护又分为FFP1、FFP2、FFP3三类,其中FFP3防护风险等级最高,检测标准为EN149:2001 + A1 2009。它们各自的要求不同见下图所示。
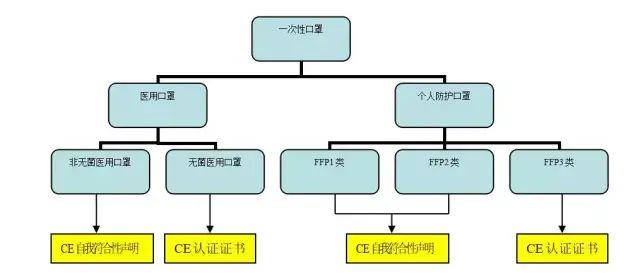
所以,只有无菌医用口罩及 FFP3的个人防护口罩才需要认证机构认证证明的CE证书。并且有授权的公告机有四位数的数字代码与之相对应。
误区二:所有的公告机构都能认证医用口罩?
A: 在欧盟从事CE认证的机构是需要欧盟委员会授权的,在其官网上有授权公告机构NB名录(Notified Body简写为NB),并有四位数的数字代码对应每一个公告机构,每个公告机构都有他取得的认证产品授权范围,是不尽相同的,其授权认证的产品范围在官网上找到该公告机构,再点击进去就可查到。
因此国内企业生产的口罩如果需要CE认证证书,必须找到一家公告机构且其具有相对应产品法规的授权,其出具的CE证书才是具有法律效力的。
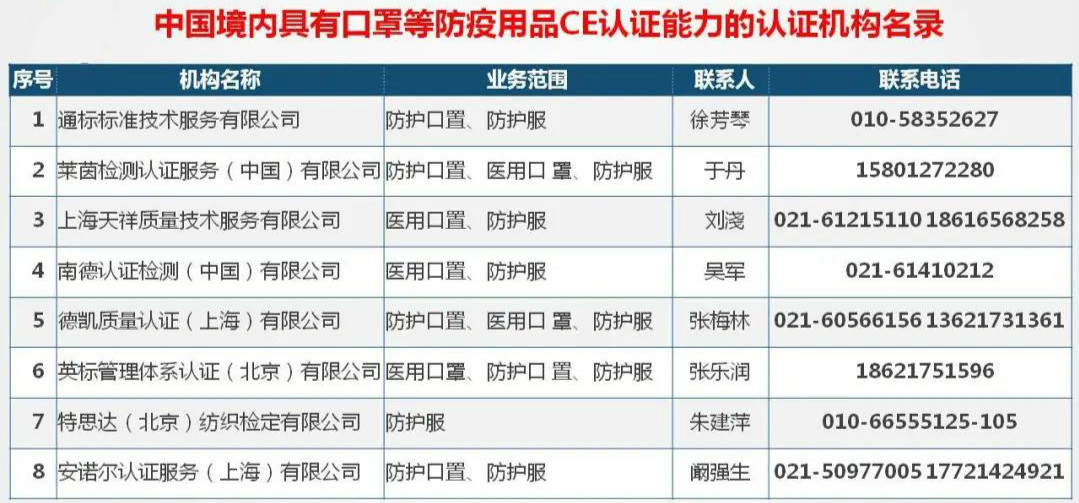
汉连小编在此也推荐几家中国境内具有口罩等防疫用品CE认证的能力的认证机构名录给大家,毕竟,现在认证证书的价格也不菲,希望大家能把银子花在刀刃上,不要白白花了钱,证书又不被认可。
关于认证的问题,还有一个注意事项:
通常情况下,一家NB仅被欧盟授权可针对某一类或几类产品进行某一种或几种模式下的认证。
我们来看下近期,我们收到的各类认证证书,不得不说,经历这一波,炼就了汉连的一双火眼金睛。
一份假的检验报告,可能让大批假冒伪劣口罩混入市场,贻害无穷。厦门汉连作为国际货运代理及具备第二类医疗器械经营备案的进出口公司,既能承接海外客户防疫物资采购委托、又能协助国内客户防疫物资的进出口通关;以下证书案例,教你学会辨认无效证书:
案例一: ECM 证书

↑ECM 公告范围不包括个人防护设备,而发放的个人防护口罩证书,属于超范围发证,证书无效。
案例二: ICR 证书

↑ICR 是欧盟在电气电子设备领域的公告机构,在医疗器械和个人防护设备领域无相应资质,属于超范围发证,证书无效。
案例三: celab 证书

↑elab是电气和电子设备产品的公告机构,在医疗器械和个人防护设备领域无相应资质,超范围发证, 证书无效。
案例四: ECM 审核证书

↑ECM 给企业颁发的一次性非灭菌(Not Sterile)医用口罩的文件审核证书。文档审查报告不是 CE 证书
案例五:TUV

↑TUV-world 不是公告机构,且一次性非无菌医用口罩应该走自我声明,不需要公告机构去认证,证书无效。
误区三:出口个人防护口罩,不需要取得CE认证证书?
A:不一定。根据误区一欧盟对于口罩的分类,个人防护口罩分为三类:FFP1、FFP2、FFP3。
FFP1和FFP2类别,生产企业也须CE自我符合性声明并在欧盟获得注册,产品上也要印有CE标识,只是后面没有四位数字代码。
FFP3类别,是必须要有授权的公告机构出具的CE证书,产品上要印有CE标识,后面加上公告机构的四位代码。
误区四:进入美国市场的医用口罩,都需要FDA认证证书?
A:不是。在美国医用口罩是由食品及药品监督管理局(FDA)管理,按二类医疗器械进行监管,生产企业的口罩产品需在FDA注册而不是认证,才能进入美国市场。
注册成功后取得注册号,FDA并不发放证书,只是给申请人发一份有FDA行政长官签名的回函,即FDA的501(K)批准函。
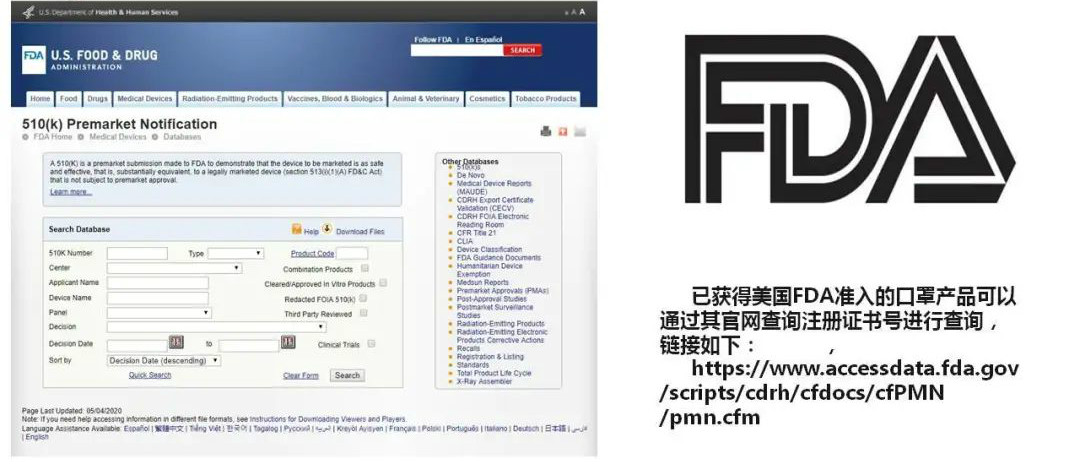
小贴士: 在其官网:https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm 上可查到510(K)上市前公告名录。FDA注册有效期为一年,超期需重新提交注册和缴费。国内企业在进行FDA注册时必须指定一个美国代表(授权代理人,公民/公司/社团),授权其负责办理与FDA之间的所有事宜。
那么个人防护口罩也需要FDA注册吗?
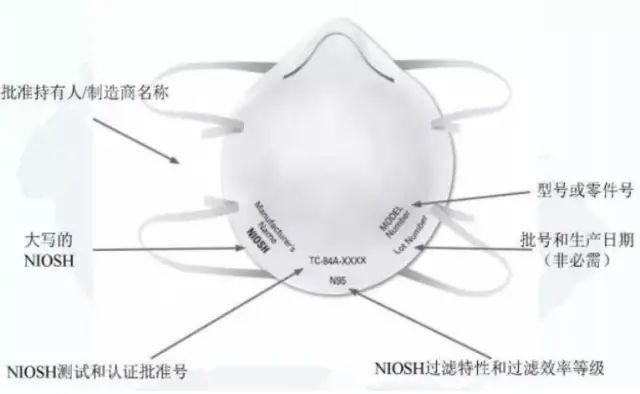
不是。在美国个人防护用品不是由FDA监管,而是由劳工部监管,美国劳工部规定进入美国市场的个人防护口罩必须取得美国国家职业安全卫生研究所(NIOSH)认证,注意NIOSH认证是有认证证书的。
如果KN95口罩要进入美国市场,就需取得NIOSH认证。
如果KN95口罩同时要作为医用口罩使用,还要进行FDA注册,即NIOSH认证和FDA注册都要做。
误区五:获得了CE认证和FDA注册的工厂,是否能一劳永逸?
A:显然并不是,5月7日,FDA官网表示,他们发现有60多家中国制造的口罩质量不合格(主要是N95口罩的颗粒物过滤效率不达标),因此将准许在美销售的中国口罩制造商数量由80家减少到14家。
产品品质始终是企业的生命线,只有通过提高生产采标、不断提升出口产品质量安全水平、提升国际竞争力,才能从根本上跨越国外市场准入的“硬性门槛”
那么,生产企业如何“对标生产”?我们来重点看下口罩的中外执行标准有何不同:
医用外科口罩

中欧医用口罩标准对比
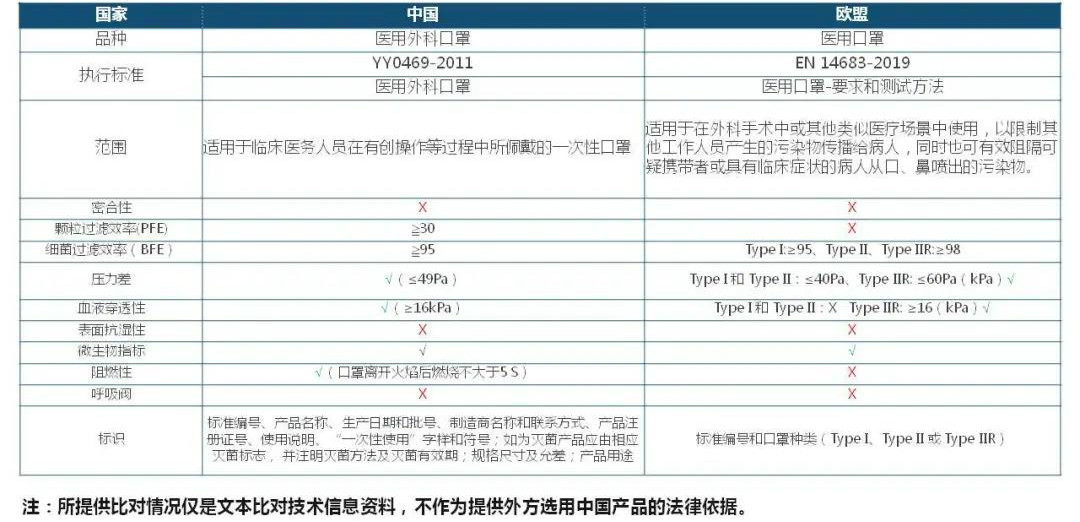
非医用口罩
个体防护装备口罩(自吸过滤式防颗粒物呼吸器)
主要用于各类存在气溶胶颗粒物的场所使用,包括各类职业场所和日常场所。主要作用通过口罩过滤材料和罩体密合性设计,阻隔液体及固体颗粒物,进入佩戴者的呼吸道。
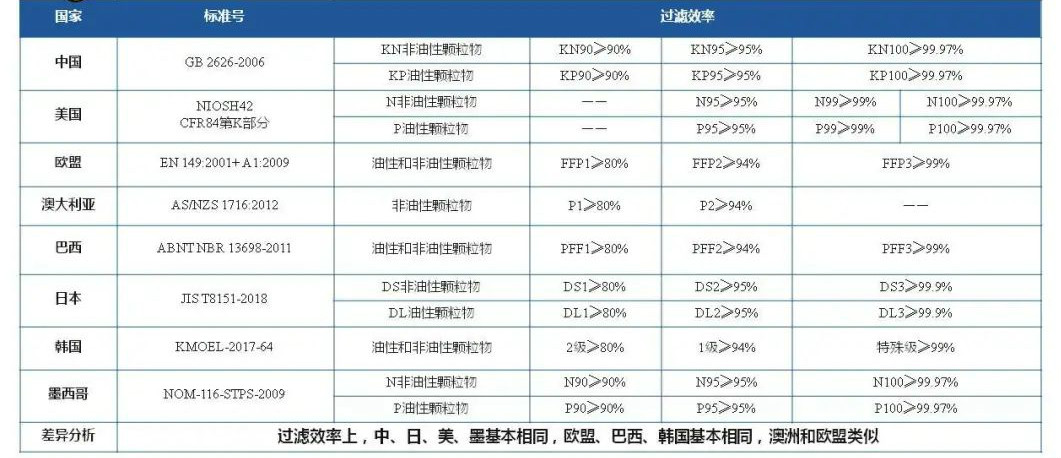
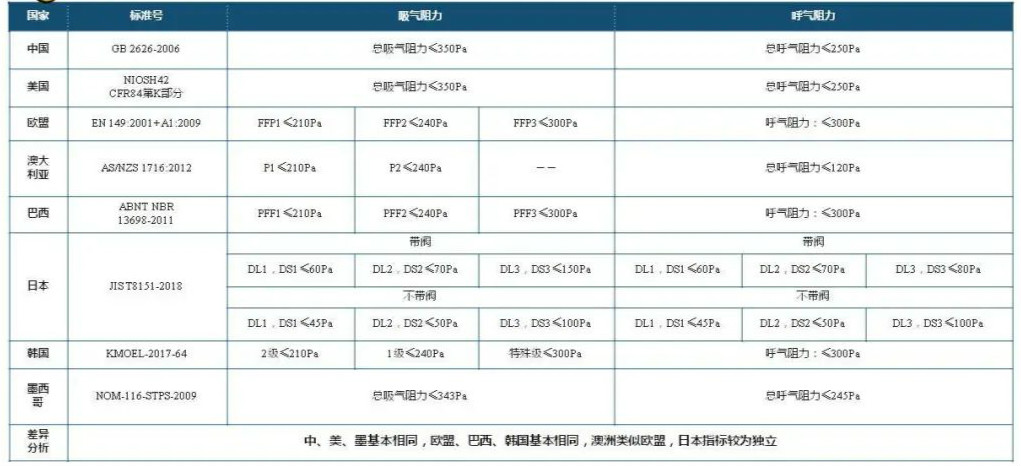
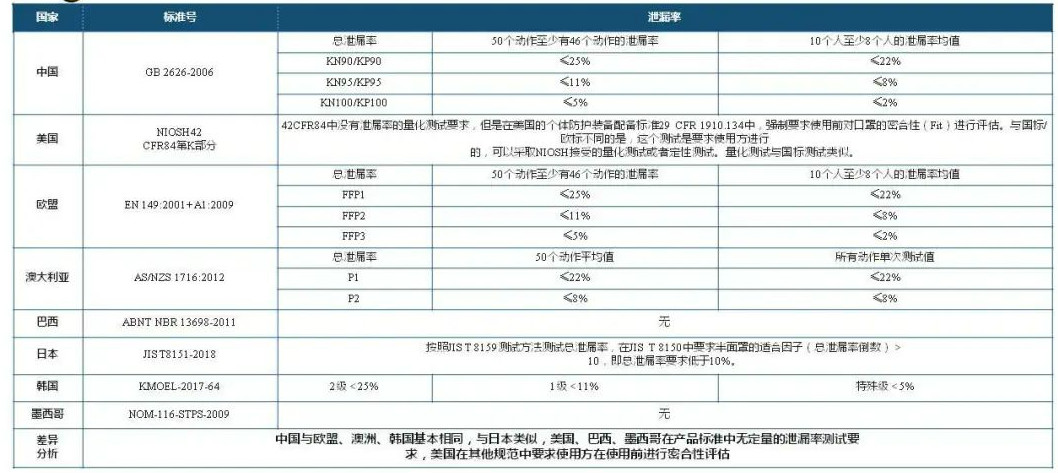
关键核心指标主要包括:过滤效率、泄漏率、呼吸阻力等。
标准对比
关于口罩出口如何“通关合规”,详见我们公众号上一期文章内容《必看!12号新规之下,出口防疫物资通关指南》
特别强调

厦门汉连供应链有限公司现已申请到第二类医疗器械经营备案,并为希腊、马来西亚、罗马尼亚、新加坡、欧美等海外客户顺利报关出口各类口罩及防疫物资,对于海关新规、口罩类型及不同国家标准资质都有专业探索。
防疫物资咨询热线TEL:15980838018(微信同号)备注企业名称,可获得免费咨询。
汉连防疫物资出口官方客服微信号:





